Hiện tượng thu hồi nội độc tố ở mức thấp (LER)
Thu hồi nội độc tố ở mức thấp (LER)
Case study này thảo luận về hiện tượng Thu hồi nội độc tố ở mức thấp (LER) trong phương pháp thử nghiệm và giảm nhẹ thuốc bằng cách sử dụng bộ ENDO-RS® và xét nghiệm ENDOLISA® để phát hiện nội độc tố.
SINCE CHEN VÀ VINTHER lần đầu tiên được mô tả một hiện tượng bào chế thuốc độc đáo khiến cho việc phát hiện nội độc tố bằng các phương pháp dựa trên Limulus không hiệu quả, có cuộc tranh luận về cách giảm thiểu hiện tượng này một cách tốt nhất. Hiện tượng này được ghi nhãn “Thu hồi nội độc tố ở mức thấp” hay LER. Cần lưu ý rằng LER có thể phức tạp do sự hiện diện của protein khuất do sự khác biệt về điểm đẳng điện của nội độc tố và nhiều protein.
Một số phương pháp giảm thiểu được sử dụng bao gồm:
a) Bổ sung các chất hoạt động bề mặt đơn giản, ví dụ magie clorua.
b) Và/hoặc thay đổi độ pH để giảm thiểu sự phân ly của các tập hợp nội độc tố trong các mẫu kiểm soát chất lượng (QC).
c) Và/hoặc việc sử dụng bộ chuẩn bị mẫu ENDO-RS® để tái tập hợp nội độc tố đã phân ly trong các xét nghiệm QC.
Việc loại bỏ hoạt tính khỏi nội độc tố trong các mẫu QC (thông qua LER) ban đầu có vẻ là một điều tốt; tuy nhiên, một số người đã chỉ ra rằng nội độc tố phân ly vẫn có hoạt tính sinh học từ góc độ miễn dịch (non-pyrogen). Schwarz phát hiện ra rằng LER phản ứng tế bào miễn dịch quan trọng được kích hoạt bởi nội độc tố. Ngoài ra, LPS đã giải độc được sử dụng làm chất bổ trợ trong vắc-xin để kích thích phản ứng miễn dịch. Ngày nay, nhiều loại thuốc quan trọng, đặc biệt là thuốc sinh học, hoạt động thông qua các đặc tính điều chỉnh miễn dịch như ức chế phản ứng tự miễn dịch hoặc kích hoạt các hoạt động phản ứng miễn dịch ung thư. Các công ty dược phẩm và Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã xuất bản các tài liệu về việc sử dụng bộ ENDO-RS để khắc phục LER. Bộ ENDO-RS (Figure 1) được tạo ra như một phương tiện kiểm tra mẫu nội độc tố với các nền mẫu khó kiểm tra.

Tổng quan về sử dụng thuốc thử
Khi các thành phần ENDO-RS phù hợp với nồng độ phù hợp được thêm vào các mẫu thêm chuẩn có nội độc tố tiềm ẩn, nội độc tố có thể được giải phóng, ổn định và được cấu hình lại thành cấu trúc có thể phát hiện được (Figure 1). Do có nhiều điều kiện và cơ chế tiềm ẩn nội độc tố nên phải phát triển một quy trình chuẩn bị mẫu ENDO-RS cụ thể cho từng sản phẩm.
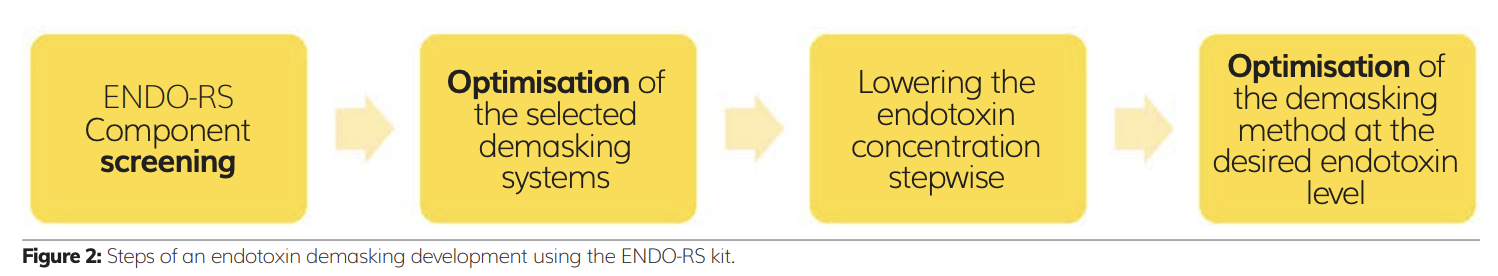
Nghiên cứu có thể được chia thành các bước sau (Figure 2):
a) Nội độc tố tăng và giữ lại để tạo thành mẫu LER
b) Sàng lọc thành phần ENDO-RS
c) Tối ưu hóa thu hồi
d) Giảm nồng độ nội độc tố (tăng mức phát hiện xét nghiệm nội độc tố)
e) Tối ưu hóa ở giới hạn thông số kỹ thuật.
Mẫu tăng nhanh để thử nghiệm
Phương pháp chuẩn bị mẫu thử nghiệm với LER giống với phương pháp (tăng và giữ trong bảy ngày) được sử dụng cho nghiên cứu thời gian lưu giữ (HTS), theo yêu cầu của FDA khi một doanh nghiệp nộp đơn xin giấy phép sinh học (BLA) để phê duyệt thuốc.
HTS trả lời câu hỏi cơ bản: “Có LER không?” Điều này tạo thành điểm khởi đầu cho thử nghiệm khắc phục LER bằng ENDO-RS và ENDOLISA®.
Thí nghiệm sàng lọc ban đầu
Những xét nghiệm này nên được thực hiện với nồng độ tăng nhanh của nội độc tố tương đối cao, chẳng hạn như 50 hoặc 100 EU/mL. Ở bước đầu tiên, đệm kích hoạt LER (citrate và polysorbate 20) được tăng thêm 50 EU/mL (Nội độc tố tiêu chuẩn kiểm soát, CSE) và giữ ở nhiệt độ phòng trong bảy ngày. Một loạt 1mL sản phẩm thêm chuẩn được chuẩn bị trong ống nghiệm thủy tinh không chứa nội độc tố. Đối với nước không có nội độc tố kiểm soát độ tăng đột biến, nước được thêm chuẩn và chia nhỏ theo cách tương tự như mẫu. Thí nghiệm thu hồi nội độc tố đầu tiên được thực hiện sau bảy ngày:
Các thành phần ENDO-RS đã được thêm vào mẫu theo hướng dẫn trong tờ hướng dẫn sử dụng của bộ chuẩn bị mẫu (Table 1). Đối với mẫu 1mL, 150µL thành phần A và 100µL mỗi thành phần B-E khác được thêm vào mẫu. Sau mỗi lần thêm, mẫu được lắc xoáy trong hai phút. Sau khi thêm thành phần cuối cùng (thường là thành phần E), mẫu được ủ không khuấy ở nhiệt độ phòng trong 30 phút trước khi pha loãng 1:10 trong nước không có nội độc tố. Việc đọc được thực hiện với xét nghiệm phát hiện nội độc tố tái tổ hợp Yếu tố C (rFC) bằng đĩa ENDOLISA. Tất cả các kết quả tiếp theo được tính toán bao gồm cả việc kiểm soát nước (kiểm soát nội độc tố). Để loại bỏ thành công, độ thu hồi phải nằm trong khoảng từ 50 đến 200 phần trăm.
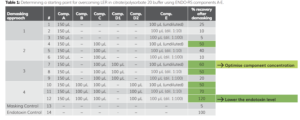
Để thu hồi 50 EU/mL citrate/ đệm polysorbate 20, việc sàng lọc được thực hiện được thực hiện như trong Table 1. Độ thu hồi tốt nhất của nội độc tố tăng nhanh được thể hiện bằng màu xanh lá cây trong Table 1.
Trong thử nghiệm đầu tiên (Table 1), các thành phần ENDO-RS khác nhau được kết hợp với nồng độ khác nhau (pha loãng trước) thành phần E, đây là thành phần chính của bộ ENDO-RS. Sự kết hợp của A và E cũng như sự kết hợp A, C và E (phương pháp thu hồi 1 và 2) không thành công lắm trong việc thu hồi nội độc tố (hồi phục <50% sau khi thu hồi). Sự kết hợp của A, C, D1 và E (không pha loãng) cho hiệu suất thu hồi là 60%, đó sẽ là một khởi đầu tốt cho các thử nghiệm tối ưu hóa. Kết quả tốt hơn thu được với sự kết hợp A, B, C, D2 và E (pha loãng trước 1:10 hoặc 1:100). Với khả năng thu hồi nội độc tố 70 và 120% ở mức tăng nhanh 50 EU/mL ban đầu. Đây là những hệ thống thu hồi cần được tối ưu hóa trong bước tiếp theo. Biện pháp kiểm soát nội độc tố tiềm ẩn (Table 1, #13) cho thấy mức tăng nhanh 50 EU/mL tiềm ẩn và không thể phát hiện được trong phạm vi 50-200%.
Tinh chỉnh phương pháp thu hồi ban đầu tốt nhất
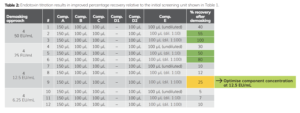
Việc cải tiến xét nghiệm bao gồm việc bổ sung dần dần các gai nội độc tố nhỏ hơn cho mẫu HTS. Mẫu (dung dịch đệm citrate/polysorbate 20) được thêm các lượng nội độc tố khác nhau (50, 25, 12,5 và 6,25 EU/mL) để xác định nồng độ nào có thể được thu hồi bằng hệ thống A, B, C, D2 và E (Bảng 2). Bằng cách này có thể đổi mới cho một phương pháp có khả năng loại bỏ một lượng nhỏ ô nhiễm nội độc tố có thể đạt được.
Kết quả về mức tăng đột biến 50 EU/mL (Bảng 2, #1-3) được sao chép so với xét nghiệm đầu tiên (Table 1, #10-12). Nồng độ nội độc tố càng thấp thì hiệu quả mong đợi của việc thu hồi hiện tại càng thấp. Do đó, các thí nghiệm tối ưu hóa nên được thực hiện đối với mức tăng nhanh của nội độc tố là 12,5 EU/mL (thu hồi 25%, Bảng 2, #9).
Bộ cấu hình (E) là thành phần ENDO-RS quan trọng nhất, được hỗ trợ bởi nhiều bộ điều biến (D1, D2 và D3*). Trong các thí nghiệm tối ưu hóa, trong đó nồng độ của các chất đệm này được thay đổi, người ta quan sát thấy rằng độ pha loãng trước của thành phần E càng cao thì khả năng thu hồi nội độc tố càng cao. Vì vậy, đối với các xét nghiệm tiếp theo, độ pha loãng trước lên tới 1:200 đã được thử nghiệm kết hợp với các nồng độ khác nhau của D2. Khi sử dụng thành phần có độ pha loãng cao hơn D2 để thu hồi, nội độc tố đạt 70-90% (Table 3, #8 #11).
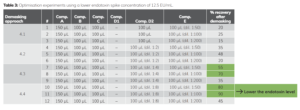
Do đó, một quy trình thu hồi đã được phát triển có thể phát hiện 12,5 EU/mL trong dung dịch đệm citrate/polysorbate 20 (mẫu LER có thêm chuẩn). Với A, B, C, D2 (1:8) và E (1:100), sau đó là độ pha loãng 1:10 trong nước không chứa nội độc tố, có thể phát hiện được 90% mức tăng nhanh 12,5 EU/mL CSE bằng xét nghiệm ENDOLISA .
Giao thức thu hồi này có thể được sử dụng để kiểm tra thêm lượng nội độc tố thấp hơn. Cuối cùng, lượng cần kiểm tra thấp hơn sẽ phụ thuộc vào giới hạn phát hiện cần thiết cho thử nghiệm sản phẩm cụ thể. Các thử nghiệm tối ưu hóa hơn nữa có thể bao gồm việc thử nghiệm các nồng độ khác nhau của các thành phần A, B và C, cũng như thử nghiệm các hệ số pha loãng khác nhau trước khi phát hiện nội độc tố. Cuối cùng, có thể phát triển quy trình chuẩn bị mẫu ổn định và đáng tin cậy bằng bộ ENDO-RS để phát hiện khả năng nhiễm nội độc tố trong các sản phẩm thuốc.
ENOLISA®
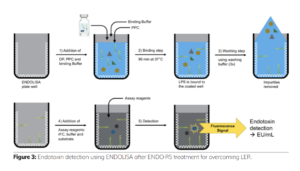
ENDOLISA®, một đĩa 96 giếng màu đen đã được phủ sẵn các protein phage tái tổ hợp dành riêng cho vi khuẩn gram âm, được sử dụng cùng với ENDO-RS để khắc phục LER. Đĩa này có thể hút nội độc tố ra khỏi các mẫu để cho phép loại bỏ hoàn toàn các mẫu (và dung dịch ENDO-RS), nếu không sẽ gây trở ngại lớn cho xét nghiệm Limulus. Sau khi loại bỏ các dung dịch lỏng, ủ và liên kết nội độc tố, đĩa dường như trống rỗng (như xét nghiệm ELISA) sau đó được phủ lên Yếu tố tái tổ hợp C và được kiểm tra bằng phương pháp huỳnh quang. Quá trình này được mô tả chi tiết trong Figure 3.
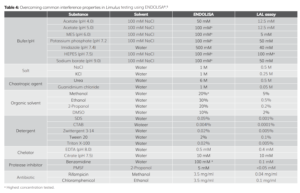
Trước khi phát hiện ra hiện tượng LER, ENDOLISA đã được phát triển để sử dụng với nhiều mẫu khó kiểm tra có đặc tính gây nhiễu phổ biến. Mức độ thử nghiệm có thể đạt được khi sử dụng ENDOLISA được trình bày bên dưới trong Bảng 4 đối với một số giải pháp rất phổ biến bao gồm các loại cụ thể: đệm/pH, muối, chaotropic, dung môi, chất tẩy rửa, chất thải sắt, chất ức chế protease và kháng sinh. Lưu ý rằng mức độ thử nghiệm đạt được được hiển thị so với mức độ đạt được khi sử dụng thử nghiệm LAL truyền thống. ENDOLISA cho thấy khả năng tuyệt vời trong việc khắc phục các cản trở mà không thể khắc phục được, trong một số trường hợp lên tới 1000X như đã thấy đối với chất ức chế protease, Benzamidine.
Hoàn thiện phương pháp kiểm tra LER
Khi đã đạt được kế hoạch phát triển, người dùng có thể kiểm tra kế hoạch này bằng cách sử dụng nhiều vật liệu khác nhau (thuốc, bộ dụng cụ xét nghiệm và thuốc thử) và, nếu muốn, sử dụng các máy phân tích khác nhau. Một xét nghiệm như vậy, sau khi được phát triển, được thực hiện xác nhận và ghi lại, sẽ không khó thực hiện thường xuyên hơn bất kỳ xét nghiệm nội độc tố vi khuẩn QC (BET) nào khác.
Nguồn: